整形美容用注射材料分类、注册与临床试验
目前,轻医美器械大致可以分为光电、注射、敷贴三大类,其中,注射类医疗美容器械与材料因增速快,备受市场关注,国家药监部门也针对此类产品发布了相关的法律法规。小编近期梳理、汇总了注射用医疗美容器械与材料的分类、适用范围、注册与临床试验方面的信息,让我们一起看看。
产品分类
按医疗手段划分,医疗美容可分为手术类与非手术类。手术类项目旨在从根本上改变或改善眼、鼻、胸等身体各部位的外观,非手术类项目(又称轻医美)主要包括注射项目、皮肤项目及其他项目。根据《禁止委托生产医疗器械目录》要求,整形填充材料、整形用注射填充物、乳房植入物均不可进行委托生产。

图1:无源医疗美容器械及材料分类
与手术类医疗美容器械及材料相比,非手术类器械及材料具有创伤小、恢复快等特点,广受爱美人士的青睐。目前,整形美容用注射材料根据成分不同,大致分为如下:

图2:注射医疗美容器械及材料分类
适用范围
截至目前,已获批的整形用注射材料类产品的适用范围主要包括:纠正鼻唇沟/鼻唇部皱纹、增加唇部容积、中面部容量缺失和/或面部轮廓缺陷、额部动力性皱纹,以及改善手部外观等。小编通过国家药监局网站医疗器械注册证查询工具粗略统计,近3年来,适用范围为纠正中重度鼻唇沟皱纹的获批产品约23项,其中,2021年批准了3项含可吸收微球产品,分别是注射用聚己内酯微球面部填充剂(国械注进20213130100)、聚乳酸面部填充剂(国械注准20213130276)、含左旋乳酸-乙二醇共聚物微球的交联透明质酸钠凝胶(国械注准20213130460)。可吸收聚酯微球具有降解速率慢,可延长填充效果等产品特点,在市场上被称为“少女针”或“童颜针”。该产品在研发或注册过程中,需要更关注产品成分、降解周期及代谢途径、凝胶粒径分布、微球粒径分布、微球材料亲疏水性能、表面稳定性(微球悬浮和分散均匀性和稳定性研究)、微球吸水性、填充剂复溶、组织相容性等多个方面,以确保产品的安全性和有效性。
此外,近3年来,有2项国产胶原蛋白类产品获批,主要适用在纠正额部动力性皱纹(包括眉间纹、额头纹和鱼尾纹),分别为注射用重组Ⅲ型人源化胶原蛋白溶液(国械注准20233131245)、重组Ⅲ型人源化胶原蛋白冻干纤维(国械注准20213130488)。据行业媒体报道,重组胶原是包括巨子、华熙生物、创健、江苏吴中等国内企业布局和发力的一个重要赛道,相信在解决产品结构、表达量低、纯化效率低等技术问题后,重组胶原蛋白类医疗美容产品也将迎来一波审批高峰。
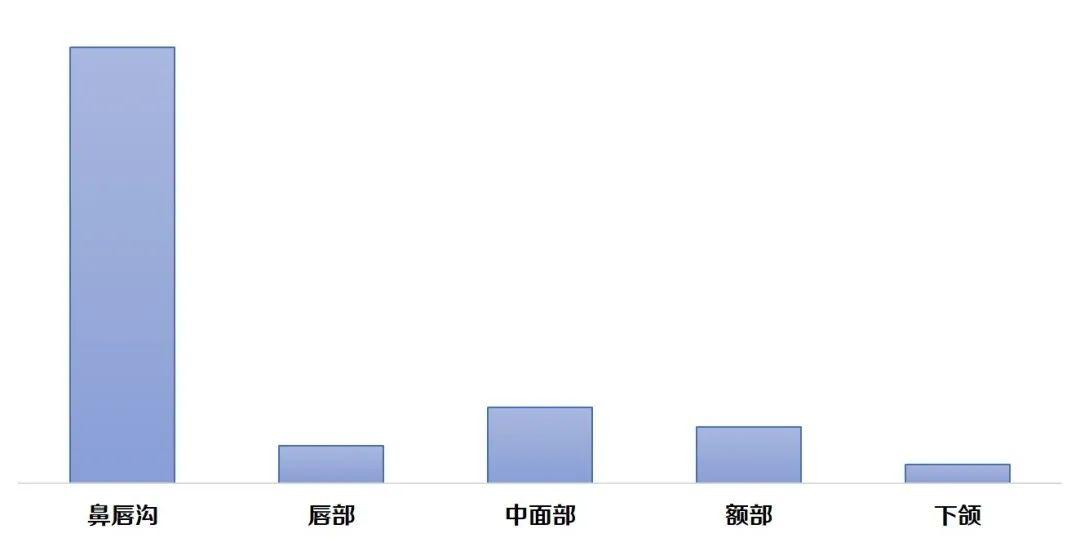
图3:已获批产品适用范围情况
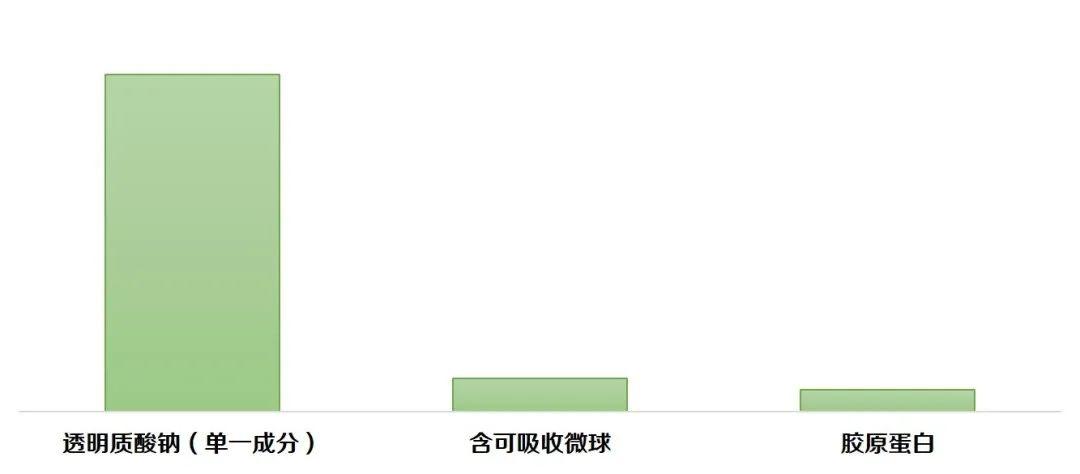
图4:不同成分产品获批情况
整形注射用填充材料暂未获批的适用范围包括面部年轻化,即补水、紧致、提亮肤色、抗衰;额部、颞部、頦部增容等。
注册与临床试验
根据《医疗器械分类目录》,整形美容用注射材料为第三类医疗器械,均需要进行临床试验研究。在观察周期上,临床试验注射后观察时间需要根据产品维持有效性的时间和观察产品安全性所需的时间确定。一般,注射后的持续观察时间需要不短于6~12个月。主要有效性评价指标采用分级评分,比如皱纹严重程度分级(WSRS)。
2023年12月11日,国家器械审评中心发布了《面部注射填充材料临床试验注册审查指导原则(征求意见稿)》,目前常见的整形用面部注射填充材料在此版征求意见稿中均有涉及,在正式稿尚未发布前,申报企业可以多与审评部门进行沟通交流,避免走弯路。

图5:指导原则、审评要点、相关标准
结束语
整形美容用注射材料属于再生医学领域,如透明质酸钠成分的产品不仅应用于医美领域,还可以被广泛应用在眼科、骨科等领域;富血小板血浆(PRP)是血小板超过生理浓度的自体血浆溶液,也已被用于创面愈合、皮肤再生、脱发和痤疮瘢痕的治疗。在产品注册申报与临床试验过程中,我们需要综合考虑产品的安全性、有效性、质量可控性等多方面因素,同时,关注产品的适用范围、材料特性,以及兼容性等问题。邦迅医药临床试验服务团队也承接了相关项目,不断学习和积累产品同时开展不同临床科室、多种适应症产品的临床项目经验,服务更加关注产品和原材料本身,协助企业实现产品价值最大化。
参考资料:
国家药品监督管理局、国家药品监督管理局医疗器械技术审评中心、审评三部刘文博老师《医美类植入性医疗器械的技术审评进展》培训等。


